1.はじめに
化学者の大きな夢の一つは、天然酵素のような高い特異性と優れた反応効率を兼ね備えた触媒分子を自由自在に創り上げることである。今日まで、新しい触媒開発のために、さまざまな方法論が検討されてきている。1986年、人工酵素を創り出すための画期的な方法論が報告された。生体防御を担う抗体タンパク質に酵素のような触媒機能が導入された1)。酵素が化学反応の遷移状態と結合し安定化することによって触媒機能を発揮しているように、遷移状態に結合する抗体は、触媒機能を獲得するようになる2)。このような触媒活性を持つ抗体を「抗体酵素」あるいは「触媒抗体」と呼ぶ。ヒトやマウスの免疫システムには膨大な抗体タンパク質のレパートリーが備わっているので、この技術を使えば、反応自体を任意に設計し、その反応を思い通りの選択性で触媒できるテーラーメイドの人工酵素を自由自在に創り出すことができる。
2.抗体タンパク質の多様性
酵素のような触媒分子を設計するにあたり重要なことは、基質と特異的に結合する「認識の場」と触媒するための「反応の場」を1つの分子の中に構築することである。抗体酵素では、「認識の場」を構築するために、免疫システムから生まれる抗体タンパク質の多様性を利用している。
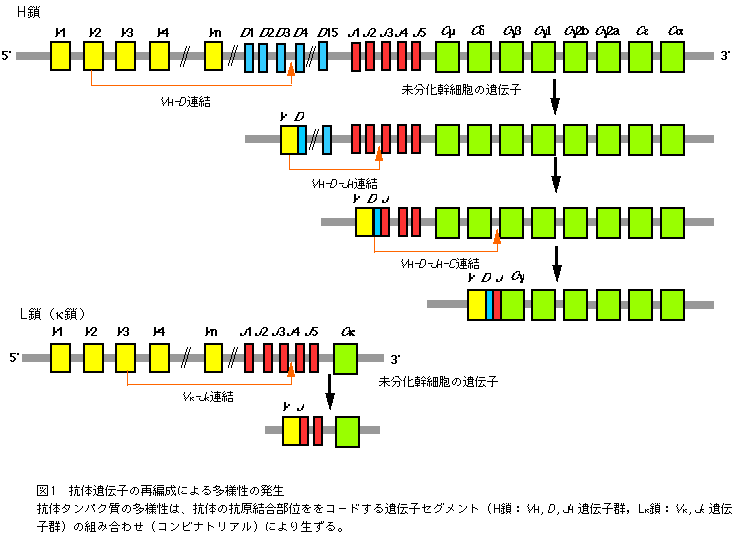
免疫系は、外から侵入してくる抗原に応答し、高い親和性と特異性をもつ抗体タンパク質を産生する。侵入してくる抗原は多種多様なものであるため、それら全てに対応するためには、抗体産生のための特別な仕組みが必要になる。抗体タンパク質の多様性は、抗体の抗原結合部位をコ−ドする遺伝子セグメント(H鎖:VH、 D、 JH 遺伝子群、Lk鎖:Vk、Jk 遺伝子群)の組み合わせにより生ずる(図1)。

マウスの場合、VH遺伝子群は100個以上の遺伝子があり、D遺伝子は約15個、JH遺伝子は5個存在する。また、L鎖を形成するVk遺伝子群は200〜300個、Jk遺伝子群は5個の遺伝子からなる。これらの遺伝子セグメントが、骨髄中の幹細胞から成熟B細胞に分化・成熟する過程で再編成される。このような仕組みで生じた特異性の異なる抗体タンパク質(108種)は、B細胞表面に提示され、外来抗原の侵入に備えている。第1免疫応答では、抗原に親和性のある抗体を提示しているB細胞がプラズマ細胞あるいは記憶細胞へと分化・増殖を始める。この増殖の過程で体細胞高頻度変異が起こり、抗体の多様性がさらに増える。あるものは体細胞高頻度変異の結果、親和性が低下し、またあるものでは親和性が向上する。そこで、第2・第3免疫に応答して、親和性のより高い抗体を提示しているB細胞が選択され、分化・増殖する(この過程をアフィニティ-・マチュレ-ションと呼ぶ)。 このような抗体の多様性を利用することで、目的の基質に応じた「認識の場」を構築することが可能になる。
3.抗体に触媒機能を付与する
先に述べたように、抗体の多様性を利用することで、テーラーメイドな「認識の場」を手に入れることができる。そこで、次の課題は「反応の場」を構築することである。今日、いろいろな方法で抗体酵素の作製が試みられているが、最も確実な方法は「遷移状態アナログ」を免疫する方法である。すなわち、抗原−抗体反応により、化学反応の遷移状態に相補的な抗原結合部位を構築する方法(遷移状態の安定化)である。
一般に化学反応は、酸−塩基触媒、静電的効果、エントロピー効果などの触媒因子により促進される。これに対して酵素触媒反応の大きな特徴の一つは、酵素が化学反応の遷移状態に結合し、それを安定化することによって反応の活性化エネルギーを減少させ、化学反応を促進していることである(図2)。
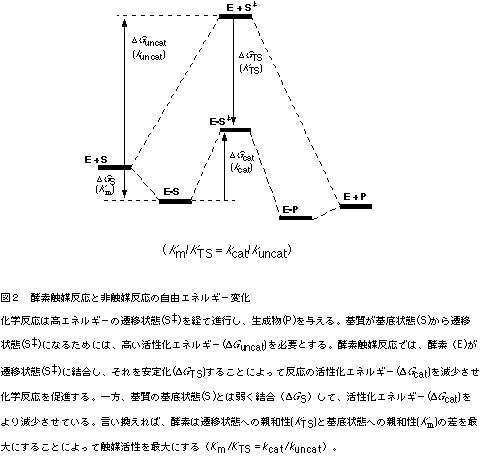
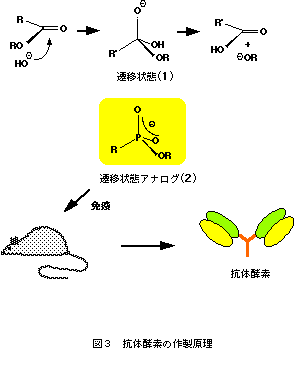
抗体酵素の触媒作用も、酵素と同様に反応の遷移状態を安定化することに基づいている。すなわち、反応の遷移状態と立体的かつ電子的に相補的な抗原結合部位を有する抗体は反応を触媒する。問題は、どうやってそのような抗体を作るかであるが、遷移状態そのものは不安定で合成できないので、免疫に用いることができない。そこで、遷移状態に立体的かつ電子的によく似ている化合物「遷移状態アナログ」を合成し、これを抗原(ハプテン)として免疫すると、得られた抗体は反応の遷移状態と結合し、安定化することによって反応を触媒する。図3にエステル結合の加水分解反応の例を示した。エステルの加水分解はカルボニル基の酸素原子上に負の電荷を持つ高エネルギーな四面体遷移状態(1)を経て進行する。この四面体遷移状態に立体的かつ電子的に相補的な抗原結合部位を持つ抗体は、反応の活性化自由エネルギーを減少させ、加水分解反応を触媒する。ホスホン酸エステル(2)は四面体構造を有し、かつ、酸素原子上に負の電荷をもつ安定な化合物であり、2が真の遷移状態(1)に近い構造単位であることがab initio計算からも支持されている3)。現在、遷移状態(1)の遷移状態アナログとしてホスホン酸エステル(2)が広く使われており、これを免疫する事によってエステル加水分解を触媒する抗体が作製されている。
4.遷移状態アナログの免疫による抗体酵素の作製
筆者らが作製した抗体酵素を例にとり、その作製法の実際について解説する。抗体酵素の最大の利点は、テーラーメイドの触媒分子が設計できることである。そこで、プロドラッグ医薬品を特異的に活性化する抗体酵素の作製を検討した。プロドラッグとは、医薬品の物性の改善や毒性軽減を目的として化学修飾された化合物であり、それ自身は薬理活性を示さないが、投与後生体の酵素やpHの変化により元の医薬品(親ドラッグ)に変換されて薬理作用を発揮するものである。もし、生体内の天然酵素に対して安定なプロドラッグをテーラーメイドの抗体酵素で活性化することができれば、病巣特異的なドラッグ・デリバリーが可能になる。そこで、モデル医薬品として抗生物質であるクロラムフェニコール(3)を取り上げ、そのプロドラッグであるエステル(4)を加水分解する抗体を作製した(図4)4)。
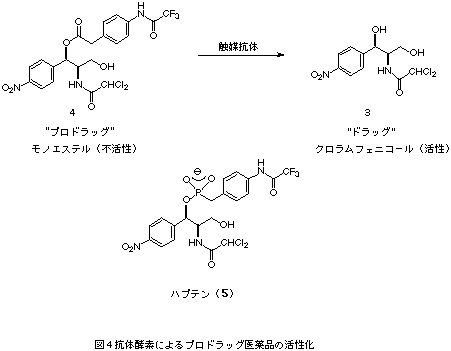
クロラムフェニコール・モノエステル(4)の加水分解反応の遷移状態アナログであるホスホン酸エステル(5)を合成した。これに結合する抗体を作製するわけだが、このような低分子化合物では免疫応答を起こさせることができない。そこで、ホスホン酸エステル(5)をある種のタンパク質(KLH)と縮合後、これを抗原としてマウスに接種し、免疫応答を誘導する。抗原の低分子部分をハプテンと呼び、タンパク質部分をキャリヤー・タンパク質と呼ぶ。その後、2-3ヶ月の免疫期間を経て、モノクローナル抗体を作製する。その結果、ハプテン(5)に結合活性を持つ11種類の抗体を作製した。得られた抗体についてプロドラッグであるモノエステル(4)の加水分解活性を検討したところ、6種の抗体に顕著な触媒活性が観測された。もっとも活性の高かった抗体6D9はMichaelis-Menten型反応速度式に従って反応を加速し(kcat = 0.133 min-1, Km = 64 mM)、抗体が無いときに比べて反応を約900倍加速した。また、反応液にハプテン (5)を添加すると、抗体6D9による触媒反応は完全に阻害された(Ki = 0.060 mM)。さらに、抗体酵素6D9によるプロドラッグ医薬品の活性化を細菌の増殖阻害実験により評価したところ、プロドラッグは天然酵素に対しては安定で、抗体酵素でのみ活性化されることが示された。
5.抗体酵素の構造と機能
5.1遷移状態理論解析
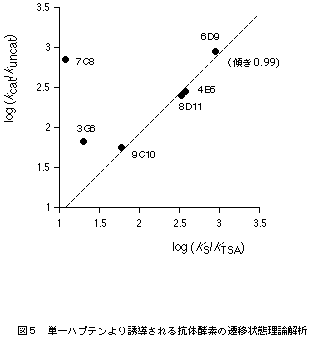
遷移状態アナログ(5)の免疫によって誘導される一連の抗体酵素の触媒活性と結合活性を表1に示す。これらのkcat値やKm値を使って遷移状態理論解析すると、触媒活性と結合活性に相関性が観測される。抗体酵素による反応が遷移状態理論に従うとすれば、その反応加速(kcat/kuncat)は基質の基底状態と遷移状態に対する抗体の結合活性の差(KS/KTS)から予測できる(図2)。遷移状態に対する親和性(KTS)は直接測定できないので、遷移状態アナログに対する親和性(KTSA)として評価すると、抗体6D9をはじめとして8D11、4B5、9C10の4種の抗体は、その反応加速と結合活性の比率はほぼ一致し、直線関係が得られた(図5)5)。すなわち、得られた抗体酵素は、エステル・カルボニル基への水酸イオンの攻撃により生じる遷移状態と結合し安定化することよって反応を触媒している。この解析が示すように、遷移状態アナログ対して高い親和性を持つ抗体が、必ずしも高い触媒活性を示すとは限らない。触媒作用の発現するために重要なことは、基質の遷移状態に対する強い結合と基底状態への弱い結合であり、その差の大きい抗体が高い触媒活性を持つ。一方、先の直線関係から大きく外れ、反応加速と結合活性の比率は一致しない抗体酵素も生成する。抗体7C8の場合、基質への結合活性と遷移状態アナログへ結合活性に大きな差がないにもかかわらず、高い触媒活性を示す。抗体7C8では、異なった触媒機構で反応を加速していることが推察される。
5.2抗体酵素の立体構造
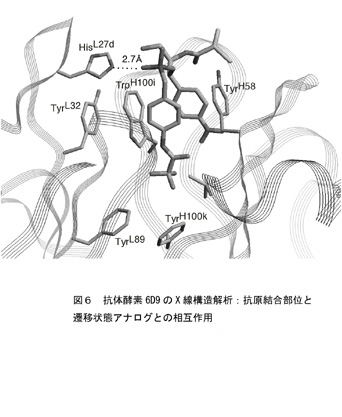
抗体酵素の触媒機構を明らかにするために、抗体6D9のX線結晶解析を行った6)。抗体酵素6D9では図6に示すように、ハプテンの2個のベンゼン環は、Tyr (H58) とTrp (H100i) とσ−π相互作用で抗原結合部位の深い位置に取り込まれている。また、遷移状態を模倣しているホスホン酸エステル部の酸素原子は、抗原結合部位の入り口に位置するHis(L27d)と水素結合している。部位特異的変異操作によりHis(L27d)をAlaに置換した抗体は全く媒媒活性を失う。以上の結果より、抗体酵素6D9においては、L鎖CDR-1領域のHis(L27d)が遷移状態のオキシアニオンと水素結合あるいは静電的相互作用し、遷移状態を安定化して触媒機能を発現している。
以上のように、一連の抗体酵素はハプテンの設計から期待される遷移状態の安定化を触媒因子として、その機能を発現している。すなわち、抗体の触媒機能は、免疫系の多様性から生まれる偶発的なものではなく、合理的なハプテンの設計によって発現されるものといえるであろう。
1) P. G. Schultz, R. A. Lerner, Science, 269, 1835 (1995).
2) W. Jenks,"Catalysis in Chemistry and Enzymology", 288, McGraw-Hill, New York (1969).
3) K. Teraishi, M. Saito, I. Fujii, H. Nakamura, Tetrahedron Lett., 33, 7153 (1991).
4) H. Miyashita, Y. Karaki, M. Kikuchi, I. Fujii, Proc. Natl. Acad. Sci. USA, 90, 5337, (1993).
5) I. Fujii, F. Tanaka, H. Miyashita, R. Tanimura, K. Kinoshita, J. Am. Chem. Soc., 117, 6199 (1995).
6) O. Kristensen, D. G. Vassylyev, F. Tanaka, K. Morikawa, I. Fujii, J. Mol. Biol., 281, 501 (1998).